撰文|张峙轩(2023级博士研究生)
审稿|谭旭
STING的功能
Hopfner, KP., Hornung, V. Nat Rev Mol Cell Biol (2020).
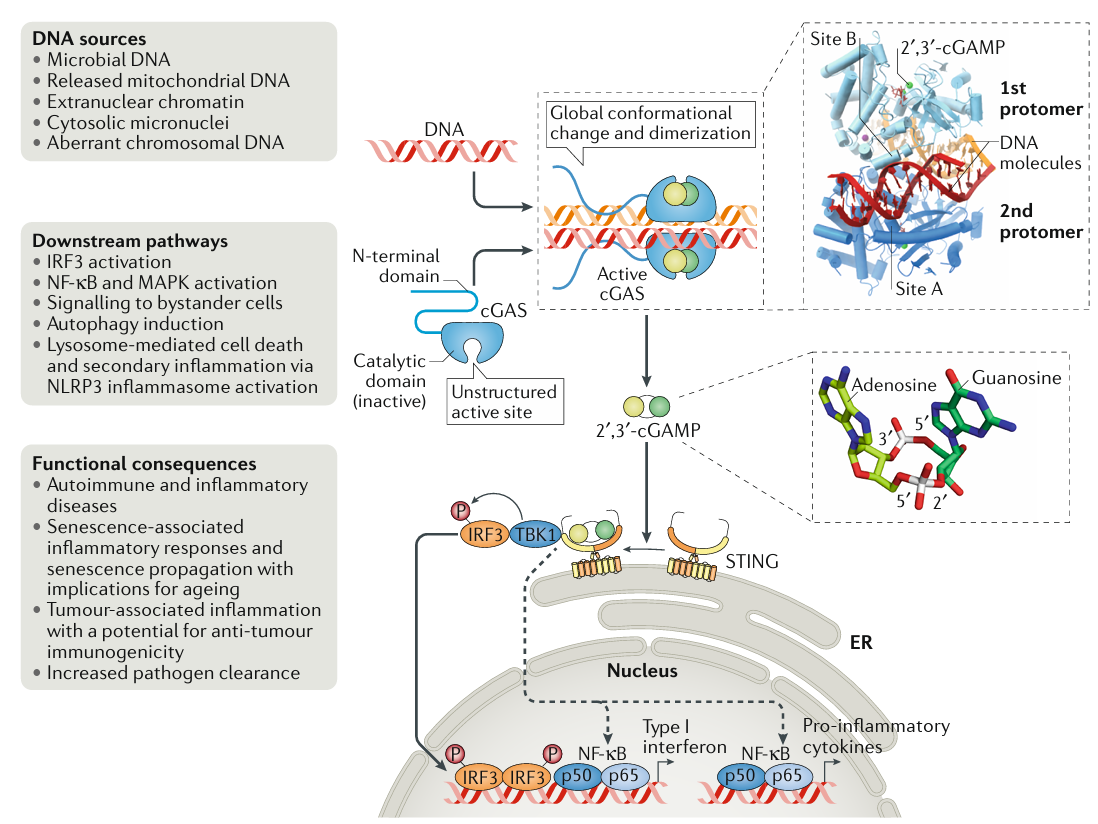
STING(干扰素基因刺激因子,stimulator of interferon genes)是哺乳动物细胞质中的一种保守受体,在识别并响应细胞质DNA方面具有重要作用。它能感知来自细菌的环二核苷酸或由环磷酸鸟苷腺苷酸合酶(cGAS)产生的环磷酸鸟苷酸(cGAMP)。一旦与其天然配体cGAMP结合,STING构象发生改变并迁移到内质网至高尔基体和内体,开启多种生物功能,包括干扰素诱导、非经典LC3B脂化和NLRP3炎症小体激活。其中,STING介导的非典型LC3B脂化也称为“非经典自噬”,对于细菌控制至关重要。尽管干扰素是通过STING介导的TBK1和IRF3激活,但STING如何激活非干扰素功能,尤其是非经典LC3B脂化和炎症小体激活的机制仍不明确。
在2023年8月发表的Human STING is a proton channel一文中,来自博德研究所(Broad Institute)的Nir Hacohen教授团队成功回答了这一科学问题。该研究利用不同的技术手段从多个方面提供了人源STING蛋白具有质子转运活性的证据。研究结果表明,人源STING蛋白的质子转运活性在非经典LC3B脂质化和炎症小体激活中发挥着关键作用。这一发现为更深入地理解STING在细胞免疫调节中的作用提供了重要线索。
1. STING激活介导高尔基体质子泄露
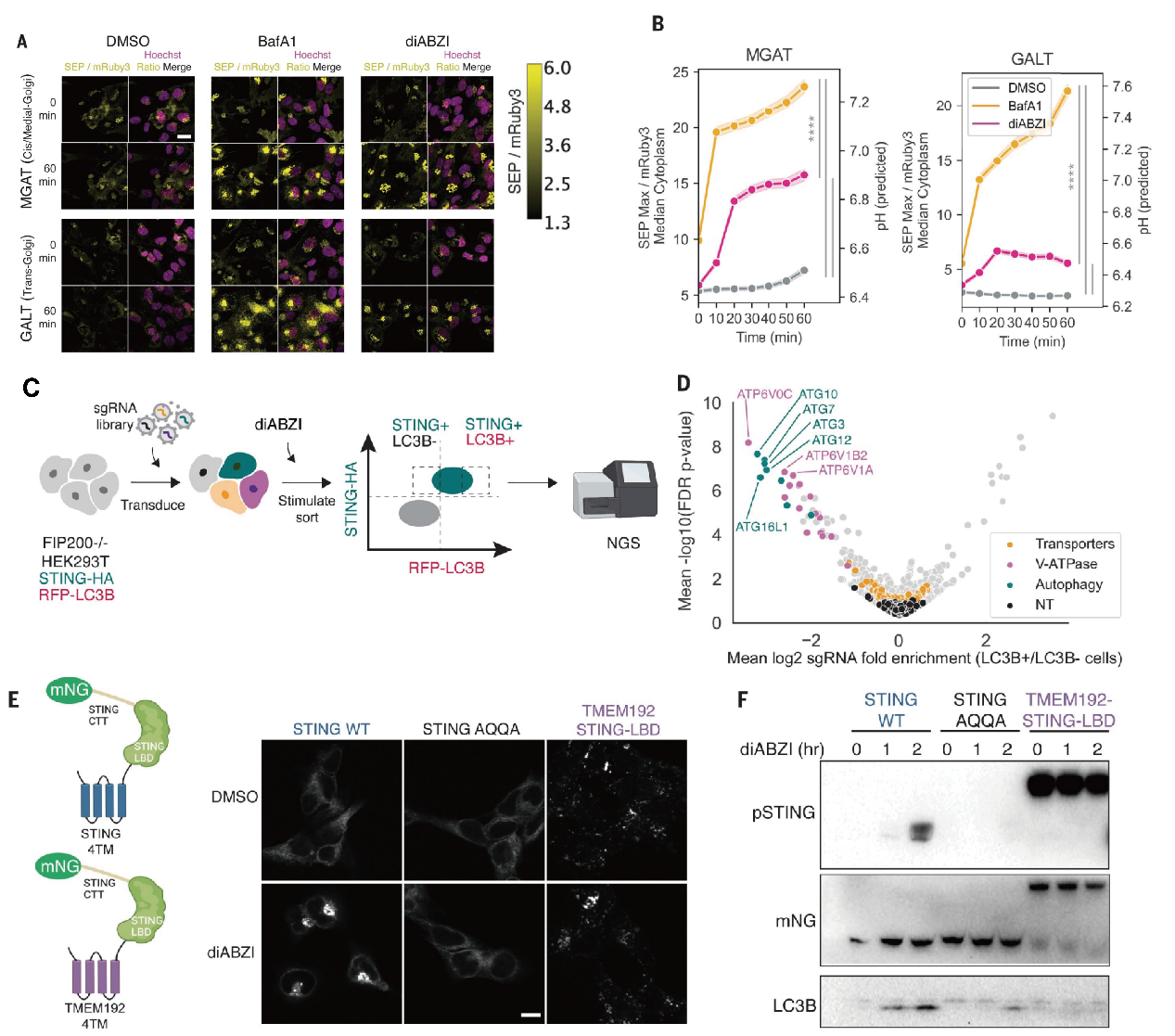
Nir Hacohen教授的团队开发了基因编码的比率型pH传感器,可以定位在近端/中央高尔基体和远端高尔基体,在BJ1成纤维细胞中,校准数据显示两种不同颜色的荧光比率与细胞内pH值相关,观察到用自噬通路抑制剂BafA1和STING激动剂处理后,两色荧光比率在高尔基体区域均增加。
研究团队旨在确定在STING激活后介导高尔基体区域pH增加的相关基因。通过进行基因组范围的CRISPR荧光激活细胞筛选,他们鉴定出V-ATPase组分和非经典自噬因子,比如ATG16L1,作为STING诱导的LC3B脂化调控因子的关键成分。现有研究表明,V-ATPase不涉及其质子泵功能,而是通过感知来自酸性囊泡的质子泄漏,与ATG16L1协同作为招募支架,来启动LC3B脂化过程。与此相对,其他已知的离子通道蛋白在STING依赖的LC3B脂化中未显现出明显的促进作用,这些虽然是阴性实验结果,但是作者认为可能提示了STING本身可能介导了观察到的高尔基体质子泄漏现象。进一步研究STING的结构域,作者发现其配体结合结构域(LBD)虽能诱导STING转位,但不足以诱导LC3B脂化,暗示STING的跨膜结构域在此过程中扮演着关键作用。
2. STING可能是质子通道,其转位后会介导高尔基体的pH升高
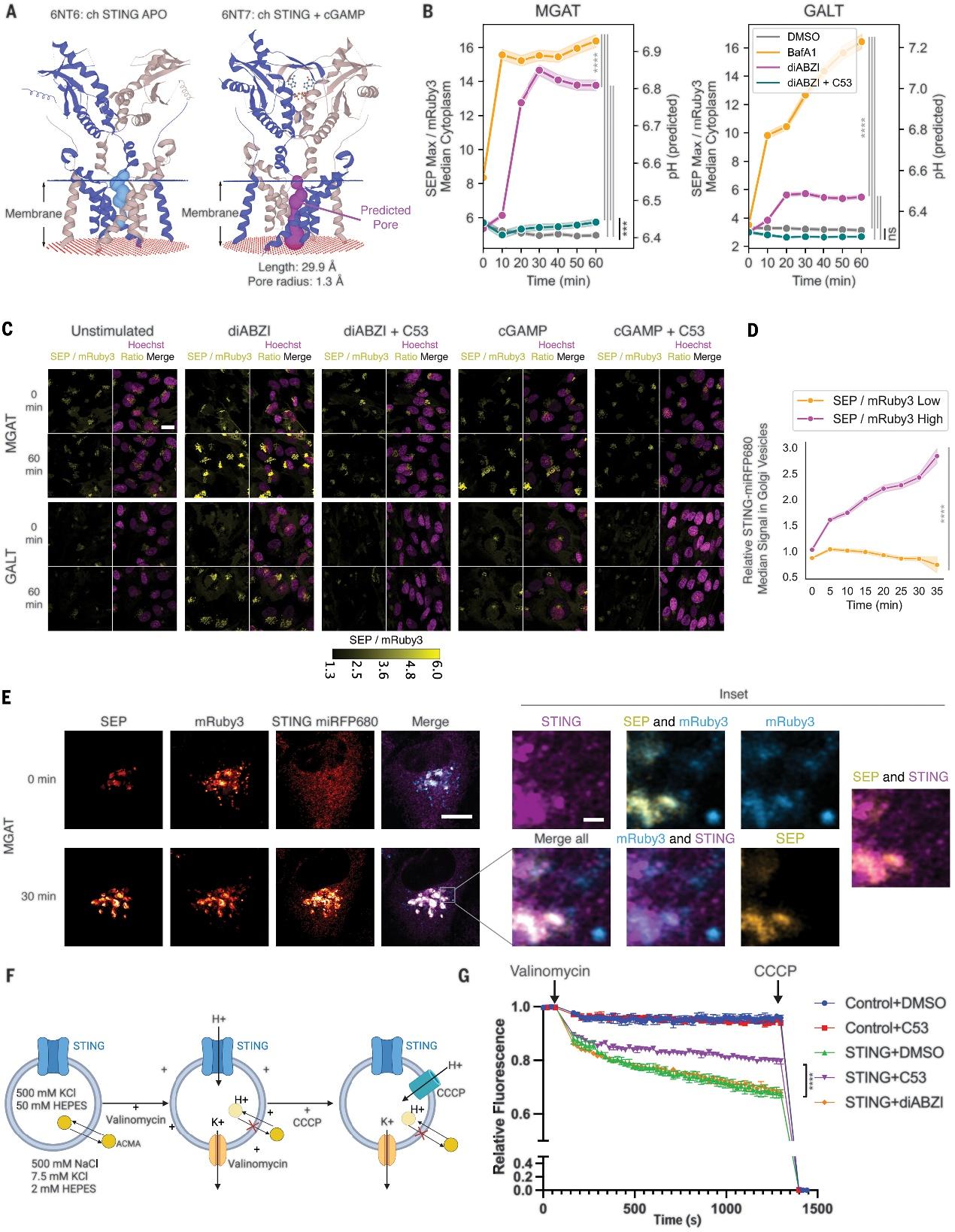
作者研究了STING在细胞内作为质子释放通道的可能性,通过分析其结构发现,与配体结合的STING形成跨膜孔道。他们观察到化合物C53能抑制STING的离子通道功能,并证实在细胞中暴露于C53和STING激动剂时,STING引发的高尔基体pH值升高明显减少,通过细胞成像也观察到STING在高尔基体囊泡中的转位,这支持了STING可能导致质子泄漏的结论。
为了评估STING在质子传输中的作用,研究团队纯化了全长人类STING并将其重新构建到脂质体中。利用pH敏感染料,他们测量了质子通量,发现STING蛋白质脂质体表现出质子通量,而C53可以减少质子通量。这表明STING似乎能够跨脂质膜传输质子。在脂质体中, STING介导的质子泄漏似乎与激动剂诱导的质子泄漏表现相似。这表明电压差异或pH梯度可能会导致STING的构象开放,并推动质子传输。细胞中激动剂的作用似乎是促使STING转位至酸性细胞器,而C53直接减少了体外STING驱动的质子传输。
研究团队通过脂质体实验发现,STING蛋白在体外可能作为质子通道,其活性受化合物C53抑制,提示其在细胞内调控质子传输的潜在机制。
3. STING质子通道的激活导致LC3B脂化
经过细胞和体外C53处理后发现STING介导的离子泄漏受到影响,团队随后探索了C53对STING激活的其他下游功能的影响。研究表明,C53处理显著抑制了STING诱导的LC3B脂化,而不影响STING磷酸化或转位。进一步的实验显示,C53联合处理抑制了STING介导的pH增加,但对C53结合弱化的STING变体的影响较小,这强调了C53对STING相关通道功能的特异性作用。
4. STING质子通道的激活也是NLRP3炎症小体激活的必要条件

已有的研究显示,除了诱导干扰素和LC3B脂化外,STING也能激活NLRP3炎症小体,但具体机制尚不清楚。与流感病毒M2孔蛋白相似,STING通过引发质子泄漏激活NLRP3炎症小体,导致细胞内NLRP3转位和启动下游炎症小体激活。在该研究中,C53处理能显著减少NLRP3转位,抑制STING诱导的炎症小体激活,而不影响nigericin引发的IL-1β释放,提示C53以一种特定于STING的方式影响NLRP3炎症小体的激活。
总结
虽然该研究揭示了STING的质子通道功能,并证明了这一功能与下游的LC3B脂化和NLRP3炎症小体产生具有相关性,但仍可能存在一些不足之处:
1.全基因组CRISPR筛选:对于全基因组CRISPR筛选发现没有已知通道蛋白的情况,可能引起一些疑问。这个阴性实验结果可能有多种解释,例如有多个冗余离子通道基因介导,这样就不能用单一基因的敲除来发现离子通道。而且全基因组筛选不能保证所有相关基因的被发现,这是作者没有提到的可能的解释。
2. C53作为一种已知的STING激活剂却抑制其质子通道的功能进而抑制STING激活炎症小体的功能,这似乎与STING的免疫激活功能有所矛盾。STING的激活干扰素通路和激活炎症小体的功能的相互关系有待进一步阐释。
总体而言,STING充当质子通道是一个很让人吃惊的发现,但是该发现还有待独立验证,其意义和机制还需要大量的后续研究来证明。