
从传统认知到分子机制的探索
口渴是生物体维持体液稳态的核心驱动力。传统观点认为,口渴主要表现为口腔与咽喉的干燥感。然而,现代研究揭示人体通过两种不同的口渴机制来精确调控体液平衡,分别对应血液渗透压变化和血容量变化的生理需求:1)高渗性口渴(osmotic thirst)由血浆渗透压升高触发,引发对水的主动摄取行为;2)低血容量性口渴(hypovolemic thirst)源于循环血量减少(如长时间剧烈运动导致的体液流失),此时肾脏分泌的肾素-血管紧张素系统被激活,促使机体同时补充水分和电解质以恢复血管内容量和组织间液平衡。这一调控系统的核心在于血脑屏障外的室周器官(CVOs),特别是穹窿下器(SFO)、终板血管器(OVLT)及正中视前核(MnPO)构成的"口渴神经枢纽"。其中SFO作为渗透压信息整合中心,其兴奋性神经元能直接感知并转化血液物理信号。光遗传学技术证实激活SFO神经元可立即引发小鼠饮水行为 1,且该神经元活性与血浆渗透压/血容量呈正相关,并在体液恢复后动态下调 2。尽管这些脑区被公认为口渴调控的“神经枢纽”,但血液渗透压如何被直接感知并转化为电信号的分子机制始终是未解之谜。
TMEM63/OSCA目前已成为已知最大的机械敏感通道家族,其在力感知中的广泛作用逐渐被揭示,在植物和动物界中均承担着重要的生理功能。2018年,闫致强教授团队首次发现OSCA家族的机械敏感性,与合作者解析了OSCA1.1和OSCA3.1的蛋白三维结构,该突破性成果发表于Nature Structural & Molecular Biology 3。2022年,闫致强团队在Nature Communications发表的研究进一步揭示,果蝇TMEM63离子通道通过调控寻水等渴觉相关行为参与水平衡调节,且该功能具有跨物种保守性——实验表明人类TMEM63B蛋白能有效挽救TMEM63基因敲除果蝇的行为缺陷 4。这一重要发现不仅证实TMEM63家族在进化过程中功能的高度保守,更为哺乳动物渴觉调控机制研究提供了关键线索。基于上述研究基础,闫致强研究团队将目光投向哺乳动物TMEM63家族成员,最终锁定TMEM63B作为潜在的高渗感知候选分子。该研究从多层面验证TMEM63B在渴觉高渗感知中的功能:
SFO兴奋性神经元的高渗敏感性依赖TMEM63B
SFO与OVLT中的内感神经元具有渗透敏感性,这一特性被认为是口渴调控的神经基础。长期以来,领域内假设这些神经元通过渗透敏感或机械敏感离子通道直接感知血液渗透压变化,但具体分子机制始终未明。为突破这一瓶颈,研究团队首先聚焦于SFO兴奋性神经元的功能验证。电生理实验发现,SFO锥体神经元在生理范围的高渗刺激(315-350 mOsm/kg)下,动作电位发放频率显著增加,且内向电流幅度与刺激强度呈正相关(图1)。所使用的高渗刺激与小鼠脱水或高渗模型中血浆渗透压的实际波动范围(360-370 mOsm/kg)匹配,提示SFO神经元的高渗敏感性具有明确的生理意义。
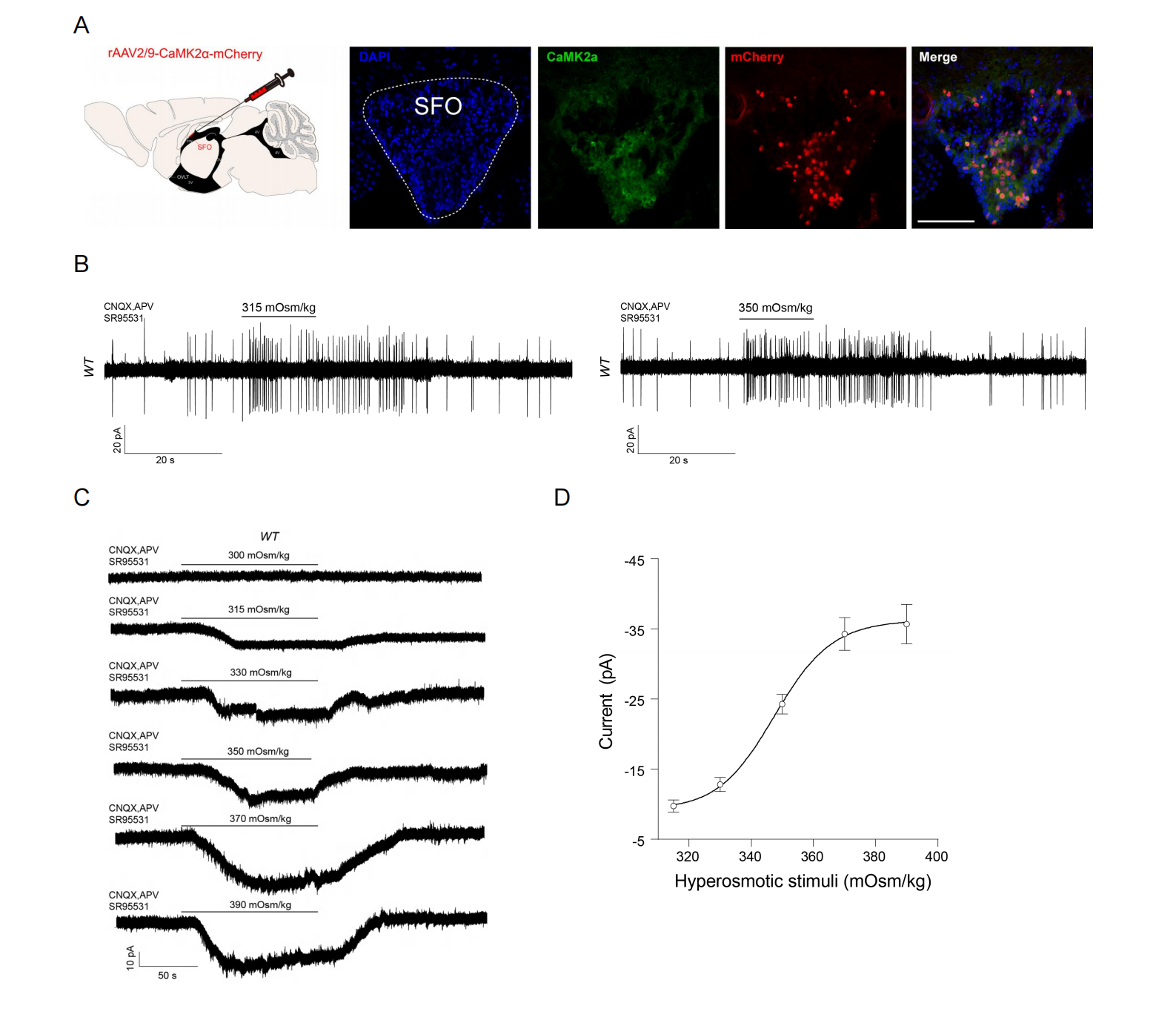
图1 SFO兴奋性神经元可以被高渗刺激激活
基于“机械敏感/渗透压敏感离子通道直接介导高渗渴觉信号”的假说,研究团队通过单细胞测序筛选了SFO兴奋性神经元中已知机械/渗透压敏感通道的表达谱,发现TMEM63B是该脑区特异性高表达的候选分子。利用基因编辑小鼠模型(Tmem63bHA-fl/HA-fl),免疫荧光染色进一步证实TMEM63B蛋白定位于SFO神经元膜表面,且与兴奋性神经元标志物CaMK2α共定位率高达80%。敲除TMEM63B后,SFO神经元对高渗刺激的反应几乎完全消失(图2),而其对谷氨酸或血管紧张素II(AngII)的响应仍保持正常,表明TMEM63B特异性参与SFO神经元高渗感知功能。
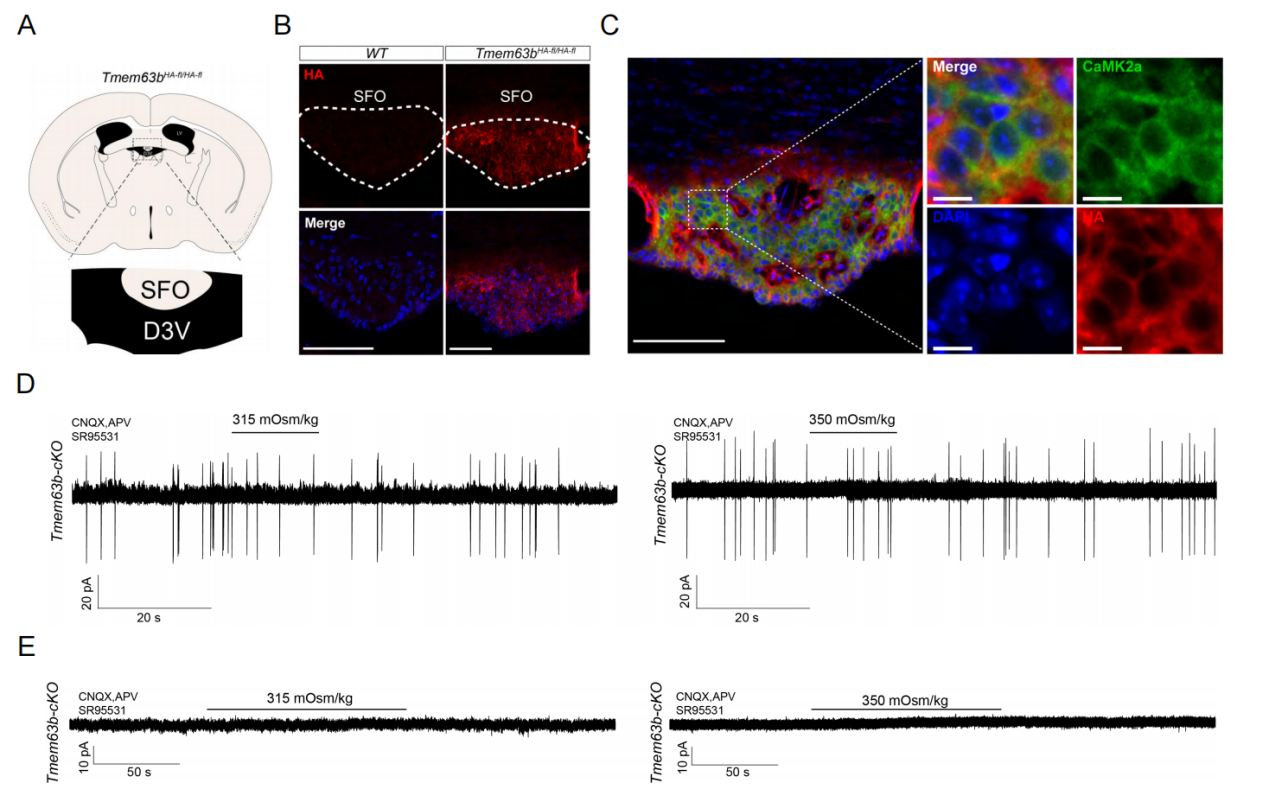
图2 高渗刺激对SFO兴奋性神经元的激活需要TMEM63B参与
异源表达系统揭示TMEM63B的高渗激活特性
为排除神经元复杂体内环境的干扰,研究团队在N2a和CHO细胞中异源表达人源TMEM63B(HsTMEM63B),直接验证其通道功能。实验显示,生理强度的高渗刺激(350 mOsm/kg)即可诱发显著的钙内流(图3),且钙信号强度与渗透压梯度呈正相关。全细胞膜片钳记录进一步证实,TMEM63B介导的电流具有典型的渗透压依赖性:从轻度高渗(320 mOsm/kg)到极端高渗(600 mOsm/kg),电流幅度逐步增强,且可被钌红特异性阻断(图3)。更重要的是,通过定点突变孔道区保守残基E510,研究者发现E510A突变显著改变通道的离子选择性。这些数据不仅证明TMEM63B是形成孔道的核心亚基,还揭示了其离子通透性的分子基础。
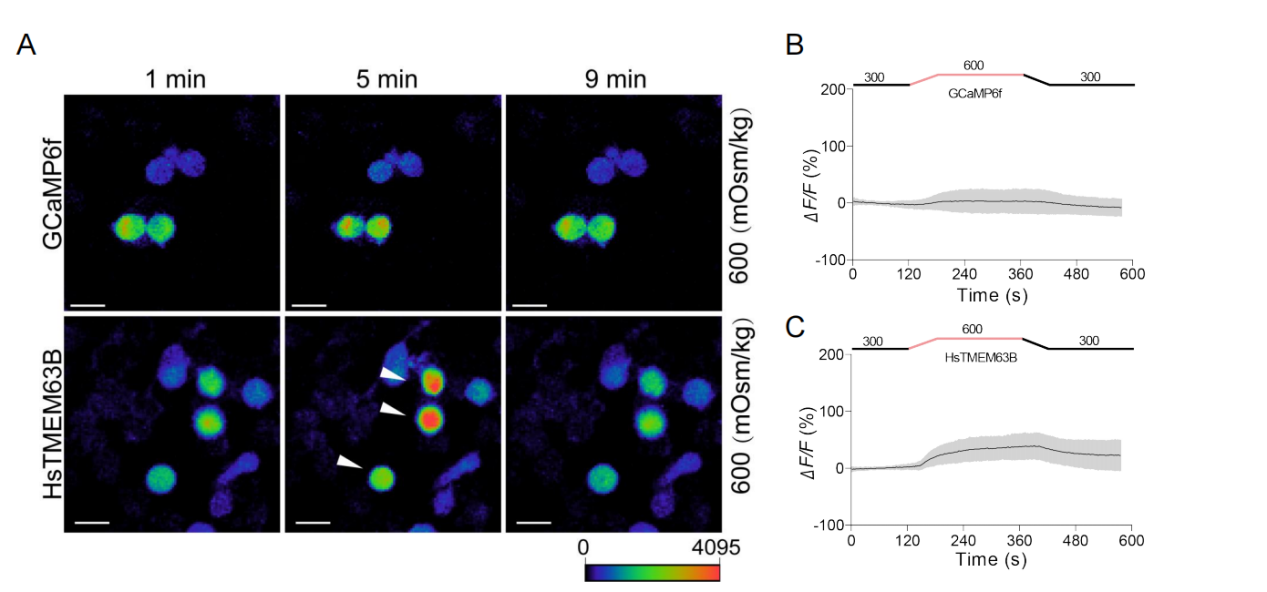
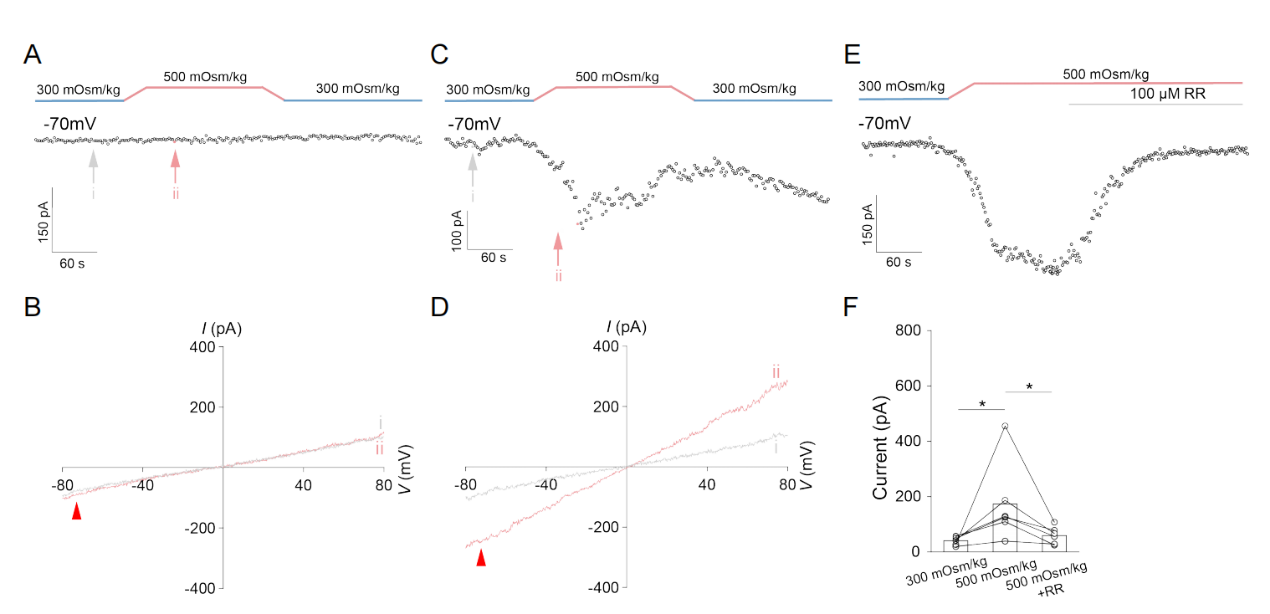
图3 异源表达TMEM63B的细胞对高渗刺激产生钙反应和内向电流
脂质体重组实验证实TMEM63B是高渗敏感通道的成孔蛋白
为确证TMEM63B独立形成功能性通道的能力,研究团队采用脂质体重组技术,将纯化的小鼠TMEM63B蛋白嵌入人工膜系统。实验显示,高渗刺激可直接激活脂质体膜上的TMEM63B通道,产生剂量依赖性的外向电流。值得注意的是,空脂质体或热变性蛋白均无类似响应,且通道活性可被钆离子(GdCl3)抑制(图4)。这一结果在无细胞环境下验证了TMEM63B的自主渗透压感知能力,彻底排除了辅助蛋白或细胞骨架的潜在影响,明确了TMEM63B是独立的高渗敏感离子通道。
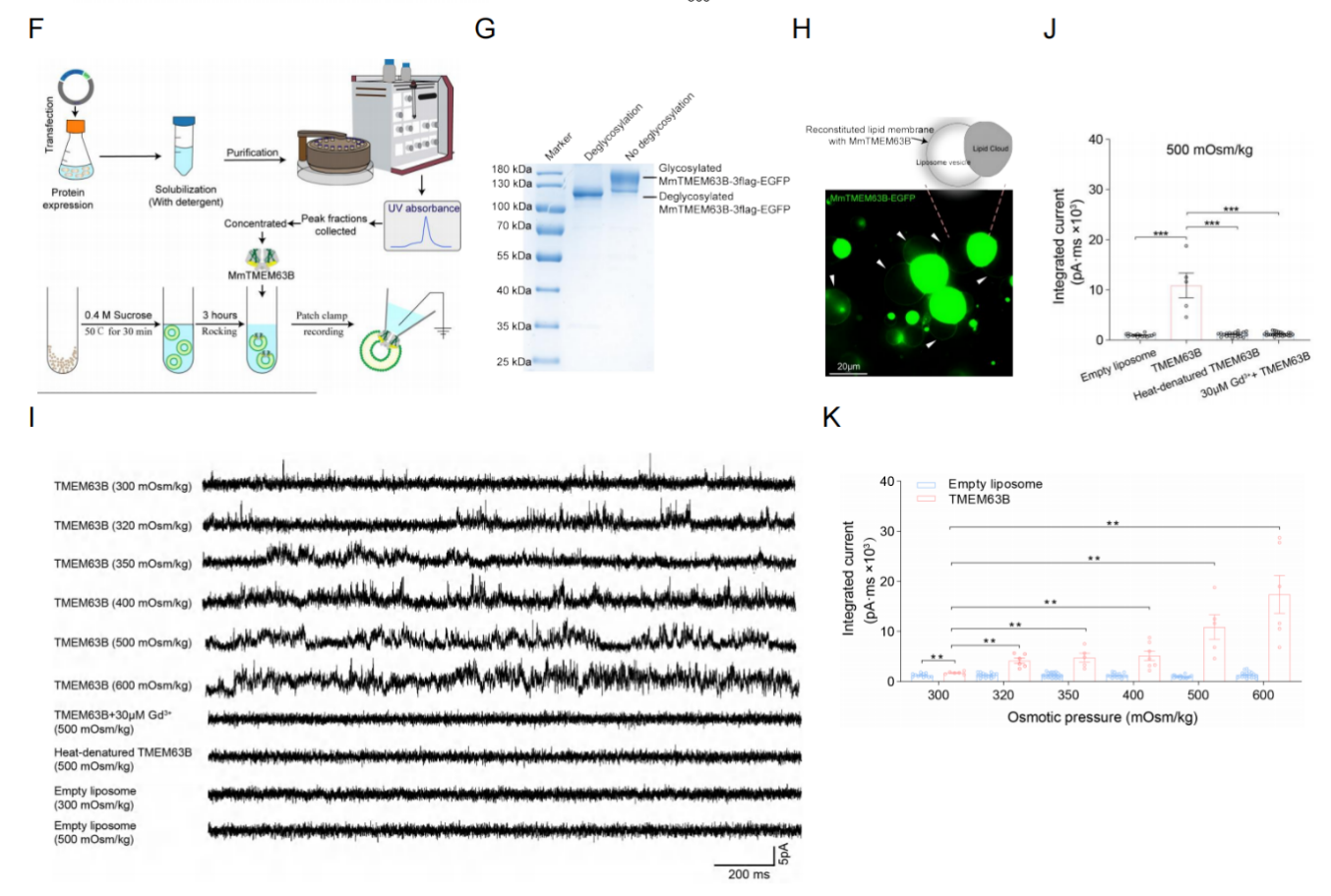
图4 TMEM63B是高渗敏感离子通道的成孔蛋白
基因敲除小鼠模型揭示TMEM63B的生理必要性
为阐明TMEM63B的生理必要性,研究团队构建了全身敲除和SFO特异性敲除(cKO)小鼠模型。c-Fos染色发现,TMEM63B缺陷小鼠的SFO神经元激活程度在高渗或脱水条件下降低80%以上,表明该通道是口渴信号传递的核心枢纽。行为学实验显示,两种模型小鼠在高渗盐水注射或48小时脱水后,1小时内饮水量均较野生型减少60%-70%(图5),而基础饮水行为无显著差异。反向遗传学实验则证明,过表达TMEM63B可使小鼠对轻度渴觉的敏感性显著增强。这些结果在动物整体层面构建了“分子-细胞-行为”的完整证据链(图6)。
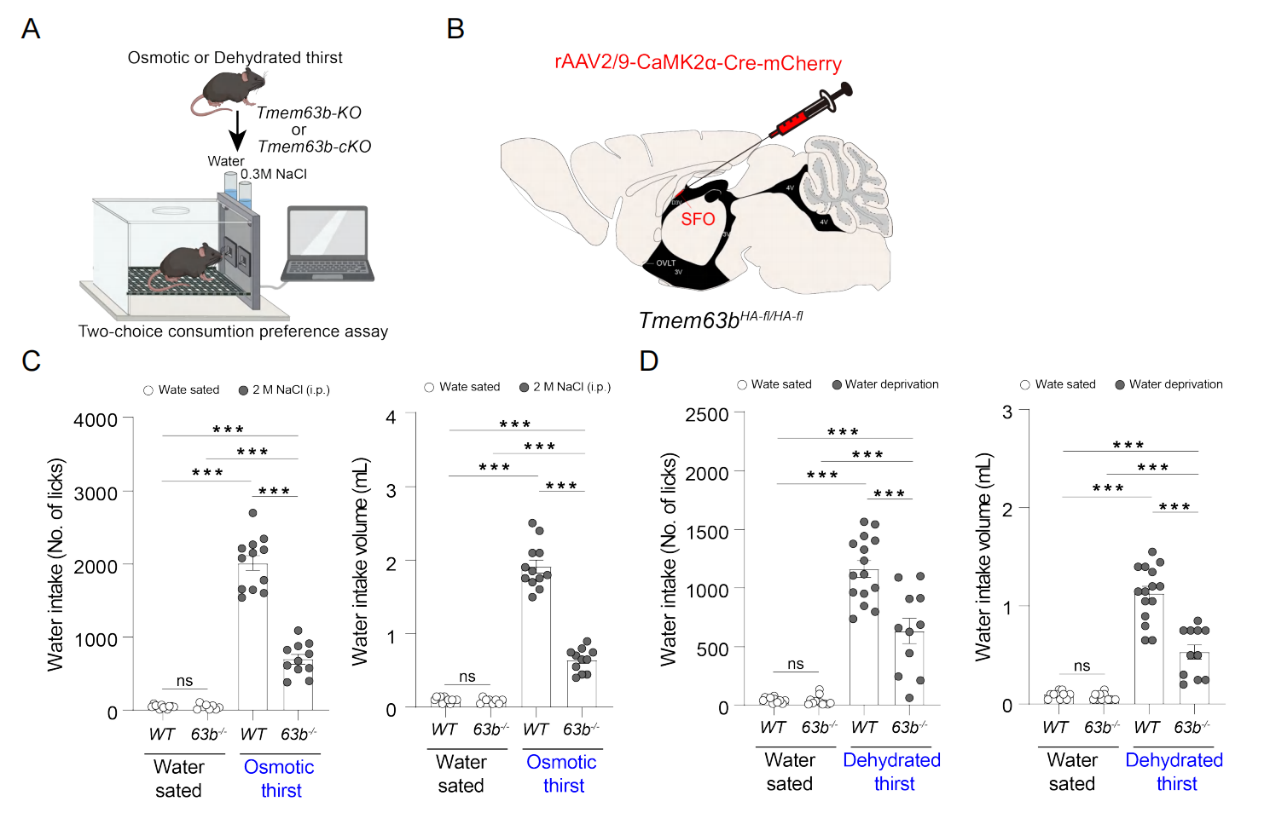
图5 SFO锥体神经元条件性缺失TMEM63B会严重损害小鼠的渴觉感受

图6 TMEM63B在哺乳动物渴觉感知中的作用示意图
闫致强团队的研究明确了TMEM63B作为哺乳动物高渗感知“分子开关”的身份,揭示了从血液渗透压变化到神经电信号转化的完整通路。这一多层次研究还揭示了TMEM63B通道在进化上的保守性——从无脊椎动物到到哺乳动物的体液平衡和渗透压调剂,该家族蛋白发挥着机械力信号转换器的功能。这一发现还为临床提供了新思路, TMEM63B功能异常可能与高血压、尿崩症等疾病相关,靶向该通道的药物研发有望成为治疗新策略。
此项研究由首都医科大学、首都医学科学创新中心闫致强教授领衔,首都医科大学博士后邹文杰、香港科技大学博士生邓锶绮、南方科技大学硕士陈兴嵛和首都医科大学硕士阮嘉敏为共同第一作者。首都医学科学创新中心王惠泽、深圳湾实验室詹屋强博士、中科院脑智卓越中心王菁欣和刘志勇研究员为合作作者。研究获得科技部科技创新2030重大项目、深圳市优秀科技创新人才培养项目、深圳市医学研究专项、国家重点研发计划项目、国家自然科学基金的资助和支持。
原文链接
参考文献
1. Oka, Y., Ye, M., and Zuker, C.S. (2015). Thirst driving and suppressing signals encoded by distinct neural populations in the brain. Nature 520, 349-352. https://doi.org/10.1038/nature14108.
2. Zimmerman, C.A., Lin, Y.C., Leib, D.E., Guo, L., Huey, E.L., Daly, G.E., Chen, Y., and Knight, Z.A. (2016). Thirst neurons anticipate the homeostatic consequences of eating and drinking. Nature 537, 680-684. https://doi.org/10.1038/nature18950.
3. Zhang, M., Wang, D., Kang, Y., Wu, J.X., Yao, F., Pan, C., Yan, Z., Song, C., and Chen, L. (2018). Structure of the mechanosensitive OSCA channels. Nat Struct Mol Biol 25, 850-858. https://doi.org/10.1038/s41594-018-0117-6
4. Li, S., Li, B., Gao, L., Wang, J., and Yan, Z. (2022). Humidity response in Drosophila olfactory sensory neurons requires the mechanosensitive channel TMEM63. Nat Commun 13, 3814. https://doi.org/10.1038/s41467-022-31253-z.

闫致强,获复旦大学学士学位、中科院神经科学研究所以及北京生命科学研究所、中科院生物物理研究所博士学位,在加州大学旧金山分校及霍华德·休斯医学研究所完成博士后研究。现任首都医科大学基础医学院教授、院长,首都医学科学创新中心资深研究员、医学生理学研究所所长。
实验室长期从事感觉神经生物学的研究,综合运用分子生物学、蛋白相互作用和结构分析、电生理记录、神经回路的光遗传、化学遗传和成像等技术手段,结合药物筛选和基因编辑小鼠模型,进行听觉、触觉、渴觉等感觉受体的鉴定和工作机制研究,感觉系统神经回路,以及感觉系统疾病的机理和治疗,并探索这些感觉受体在其他重要生理功能中的作用。
创新中心正在招聘医学大数据与人工智能领域的独立PI,欢迎从事医学大数据、人工智能等领域研究的学者申请:创新中心招聘医学大数据与人工智能领域PI
闫致强实验室长期招聘博士后、副研究员/助理研究员等岗位及招收博士研究生,详情请点击查看:创新中心闫致强实验室多岗位招聘