
 lmwang83(at)cimrbj.ac.cn
lmwang83(at)cimrbj.ac.cn
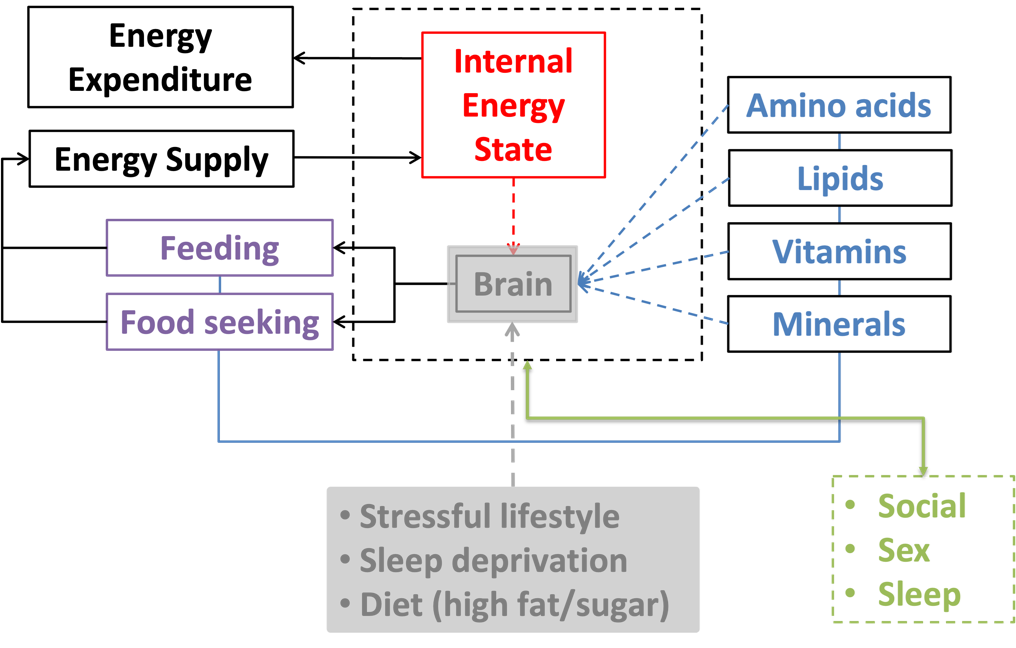
过去十年中,王立铭实验室的研究工作主要聚焦于生物机体能量和营养物质稳态的神经调控机制。更具体地说,王立铭实验室的兴趣在于理解以下问题:大脑如何检测体内能量和重要营养物质储存的变化;大脑如何启动各种行为来满足能量和重要营养物质短缺时的需求;持续的生活方式挑战如何影响大脑维持能量和营养稳态的功能;大脑如何协调食物摄入与其他重要的先天行为,如社交、性行为和睡眠;大脑如何与外周器官互动,在代谢变化时协调代谢重塑。
1. 觅食行为的代谢和神经调控
动物的生存和健康依赖于能量摄入与消耗之间的精确平衡。作为严格的异养生物,动物需要准确地检测体内的能量状态,并持续地寻找、占领、利用和消耗合适的食物来源,以确保足够且均衡的能量摄入。在过去的20年中,关于进食行为的调控已进行了广泛研究。然而,作为食物摄取的前提条件、能量摄入的重要组成部分,觅食行为的机制仍然在很大程度上是个空白。
王立铭实验室建立了第一个果蝇的定量觅食行为范式。他们发现,饥饿会在成年果蝇中引发持续且可逆的运动,并且这种由饥饿引发的过度活动是为了定位和获取食物来源。因为通过中枢营养感应机制和外周甜味感应机制,食物线索的检测可以通过诱导进食来抑制这种活动。通过使用这种定量的觅食行为范式,王立铭实验室筛选了主要的神经递质和神经肽分子,发现了蟑胺(OA, octopamine),即昆虫中的去甲肾上腺素的对应物,以及表达OA的神经元,在饥饿引发的觅食行为中起到了关键作用。综合来看,他们的结果建立了一个定量的觅食行为范式,,并鉴定了将机体代谢状态与特定行为输出相联系的保守神经信号。
王立铭实验室还鉴定了觅食行为的核心神经回路。定量觅食范式的建立以及OA作为关键神经调控因子的发现,为进一步研究觅食行为的调控机制铺平了道路。通过进行系统的RNAi筛选,他们鉴定出了脂肪动员激素受体(AKHR, adipokinetic hormone receptor),即昆虫中的胰高血糖素类似物,在饥饿引发的觅食行为中是必需的。重要的是,他们还发现AKHR在果蝇脑中的一小群OA神经元中表达。沉默这些AKHR+神经元或阻断这些神经元中的OA信号,都会消除饥饿引发的觅食行为,而激活这些神经元会加速饥饿状态下觅食行为的发生。AKHR+OA+的神经元并未参与饥饿引发的进食增加,这再次表明饥饿引发的食物寻求和进食行为是独立调控的。此外,AKHR+OA+神经元的单细胞RNA测序还鉴定出了果蝇胰岛素样受体(dInR)的共表达,该受体对饥饿引发的食物寻求产生抑制作用。因此,胰岛素和胰高血糖素信号通过果蝇中的一个共同OA靶点对饥饿引发的觅食行为产生相反的影响。
王立铭实验室阐明了不健康饮食如何破坏正常觅食行为的调控。与哺乳动物研究类似,他们发现高脂饮食(HFD, high-fat diet)显著增强了饥饿引发的觅食行为,而不会干扰果蝇的代谢或其进食行为。这种效应可能导致了高脂饮食摄入后动物的行为异常以及肥胖的出现。他们发现,高脂饮食通过增加饥饿激素AKH的受体AKHR在这些神经元中的积累,增强了前述核心神经回路(AKHR+OA+神经元)对饥饿信号AKH的敏感性。因此,调控饥饿引发的觅食行为的同一组神经元,也是高脂饮食影响觅食行为的神经靶点。
在机制上,高脂饮食后,多余的脂质通过脂蛋白LTP被转运进入这些AKHR+OA+神经元,并通过其对应受体LpR1激活AMPK-TOR信号,抑制自噬依赖的AKHR降解,从而增加了这些神经元对饥饿信号的敏感度。总的来说,王立铭实验室揭示了一个连接高脂饮食与觅食行为的机制,帮助人们更好的理解代谢异常状态下,动物神经回路如何重塑,以及代谢疾病如何发生。
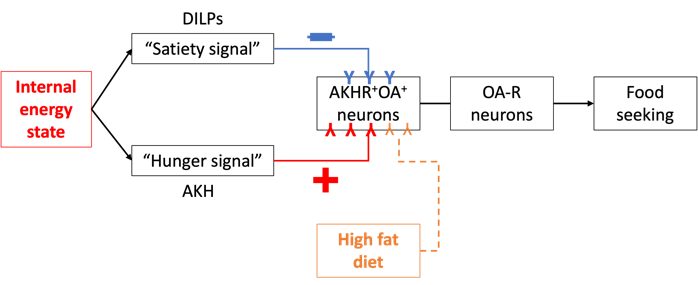
生理和病理条件下觅食行为的代谢和神经调节。
综上所述,王立实验室在理解果蝇觅食行为方面做出了重要贡献。他们全面且定量地描述了这种行为,鉴定了调控觅食行为的核心神经回路,并揭示了不健康饮食如何影响该回路的分子和细胞机制。王立铭实验室将继续研究觅食的调控、觅食与进食之间的相互作用,并将他们的研究项目扩展到啮齿动物模型中。

王立铭实验室的另一个主要研究方向是探讨中枢神经系统如何检测重要营养物质,尤其是糖类和氨基酸水平的波动,以及如何通过相应的行为输出来维持这些营养物质的稳态。啮齿动物的研究表明,位于下丘脑的特定神经元在感知体内能量状态和调节食物摄入方面起着关键作用。然而,最近的研究对这些神经元在进食调控中的必要性提出了质疑,突显了大脑在细胞和分子水平上感知和响应不同类型营养物质的复杂性,并表明了系统性鉴定新的营养感应器的必要性。
为此,王立铭实验室开发了一种简单且定量的食物摄取测定方法,名为果蝇手动进食(MAFE)测定法。在这种方法中,个体成蝇被固定,并直接呈现填充有液体食物的精细毛细管,记录每次进食行为的食物摄取量。通过使用这一测定法,他们进行了系统的RNAi筛选,发现了果蝇速激肽(TK,Tachykinin),即哺乳动物P物质的果蝇同源物,以及其相应受体TAKR99D,是强效的进食抑制因子。实际上,尽管TK在果蝇脑中的多个神经元群中表达,他们发现只有两对位于上内原脑区的TK+神经元能够直接被循环系统中的葡萄糖所激活,并对进食产生抑制作用。此外,这些TK+神经元通过TAKR99D+神经元形成了一个双突触回路,靶向胰岛素细胞(一种众所周知的进食抑制因子),且这个回路可以在食物摄入过程中迅速激活并终止进食。总的来说,王立铭实验室鉴定了果蝇大脑中的一种新的糖感应器,能够检测特定的循环营养物质,并进一步调节进食行为,揭示了能量稳态的神经调控机制。
除了糖感应器外,王立铭实验室还非常感兴趣于了解中枢神经系统如何检测氨基酸。作为重要的营养物质,氨基酸能够被各种动物物种的外周神经系统检测到,从而引发一种有吸引力的“鲜味”感。mTOR信号通路在下丘脑中也发挥着感知循环氨基酸并抑制啮齿动物进食的作用。然而,大脑如何检测饮食中的氨基酸组成并产生不同的反应仍然大部分未知。近年来,王立铭实验室鉴定出了两种具有不同代谢和行为功能的中枢氨基酸感应器。
王立铭实验室在果蝇大脑中鉴定出了一种摄食后氨基酸感应器。通过使用MAFE测定法,他们发现三种氨基酸,L-谷氨酸、L-丙氨酸和L-天冬氨酸, 而不是它们的D-对映体或其他17种天然L-氨基酸的组合, 能够快速促进果蝇的食物摄取。体内和体外的钙成像显示,表达利尿激素44(DH44,哺乳动物促肾上腺皮质激素释放激素的果蝇同源物)的六个大脑神经元能够被这些氨基酸快速直接激活,表明这些神经元是氨基酸感应器。DH44+神经元的失活消除了由饮食氨基酸引起的食物摄取增加,而这些神经元的基因激活则足以促进进食,表明DH44+神经元介导了饮食氨基酸促进食物摄取的作用。单细胞转录组分析和免疫染色显示,CG13248(一种氨基酸转运蛋白)在DH44+神经元中富集。在DH44+神经元中敲低CG13248表达,阻止了氨基酸诱导的食物摄取增加,并消除了由饮食氨基酸引发的钙响应。因此,这些数据表明DH44+神经元是一种关键的氨基酸感应器,通过一个假定的转运蛋白CG13248来检测氨基酸并增强食物摄取。
王立铭实验室还鉴定出了一种在果蝇大脑中感知半胱氨酸的特异性感应器,它具有同时抑制进食和促进脂肪燃烧的作用。与人类实践中的观察相似,他们发现富含蛋白质的饮食显著减少了果蝇体内的脂肪储存,这在很大程度上归因于饮食中的半胱氨酸摄取。在机制上,饮食中的半胱氨酸直接激活了一小群表达神经肽FMRFamide(FMRFa)的神经元,并促进了FMRFa的释放。增强的FMRFa活性同时通过其相应受体(FMRFaR)促进能量消耗并抑制进食,两者共同促成了脂肪减少的效果。在脂肪体中,FMRFa信号通过增加PKA和脂肪酶活性促进脂解。在甜味感应味觉神经元中,FMRFa信号抑制了食欲感知,从而减少了食物摄取。他们还证明,饮食中的半胱氨酸通过哺乳动物的NPFF信号,以类似的方式发挥作用。此外,饮食中的半胱氨酸或FMRFa/NPFF的使用在不引发行为异常的情况下,对果蝇和小鼠的代谢应激具有保护作用。因此,他们的研究揭示了一个新的靶点,用于开发安全有效的抗肥胖及相关代谢疾病的治疗方法。
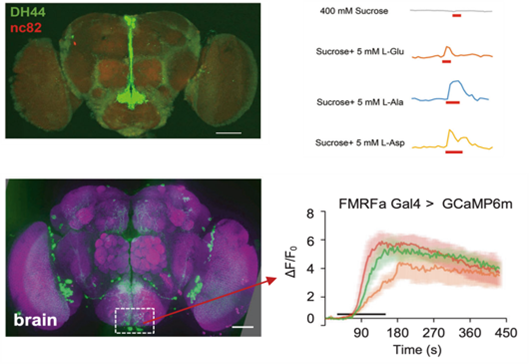
苍蝇大脑中的两个新型氨基酸传感器。(上)DH44+神经元及其对丙氨酸、谷氨酸和天冬氨酸的反应。(下)FMRFa+神经元及其对半胱氨酸的反应。






